- Blog - Laboratorio y ciencia - DISOLVENTES: TIPOS, USOS E IMPORTANCIA EN LAS CIENCIAS
Los disolventes son sustancias químicas ampliamente utilizadas y fundamentales en muchas áreas de las ciencias, incluyendo la química, la biología y la farmacia. Como su nombre indica, estos compuestos tienen la capacidad de disolver, pero también transportar moléculas en solución (los llamados “solutos”).
Por ejemplo, en reacciones químicas, los disolventes suelen actuar como medio de reacción, pero además pueden influir directamente en la reactividad y en las propiedades físicas y químicas de las disoluciones. Esto los convierte en herramientas esenciales en áreas como la investigación, el análisis o el desarrollo de nuevos productos químicos y materiales.
En este artículo exploraremos qué son los disolventes, sus tipos, y algunos de sus usos más comunes en química y biología, destacando su relevancia en la práctica científica.

¿Qué son los disolventes y qué tipos hay?
Los disolventes se definen como sustancias capaces de disolver un disoluto, formando una disolución, en la cual el disolvente representa normalmente la mayor parte de la mezcla. Aunque existen disolventes gaseosos, sólidos o en estado supercrítico, en el ámbito del laboratorio los más habituales son los disolventes líquidos.
Una de las formas más frecuentes de clasificar los disolventes es según su polaridad, es decir, la distribución de carga en sus moléculas.
Disolventes polares: el caso del agua y otros ejemplos clave
Los disolventes polares son aquellos cuyas moléculas tienen una distribución desigual de cargas, generando una zona parcialmente negativa y otra parcialmente positiva. Esta polarización les permite interactuar eficientemente con solutos polares o iónicos, según la regla general de “lo similar disuelve lo similar”.
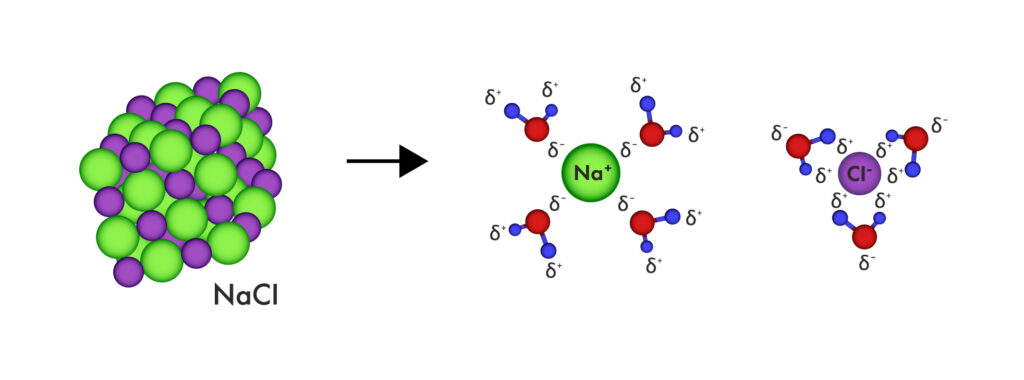
Esquema de la disolución en agua e hidratación de un cristal de cloruro de sodio (NaCl), la sal común.
Ejemplo: el agua
El agua es el disolvente polar más común y biológicamente relevante. Por ejemplo, el citoplasma de las células está compuesto en gran parte por agua, donde se disuelven (y dispersan) una gran variedad de moléculas: azúcares como la glucosa, iones como el sodio o el cloruro, y muchas otras.
Incluso en la vida cotidiana, vemos este comportamiento: al cocinar, la sal de mesa (NaCl) se disuelve fácilmente en agua caliente gracias a su polaridad.
Otros ejemplos de disolventes polares
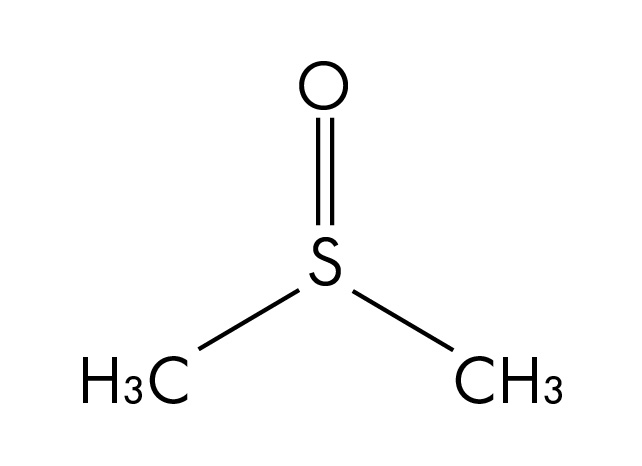
Estructura molecular del dimetilsulfóxido (DMSO), un disolvente polar aprótico.
Disolventes apolares: medio inerte para reacciones específicas
Los disolventes apolares tienen una distribución uniforme de la carga eléctrica, lo que les permite disolver compuestos apolares, como grasas, ceras o hidrocarburos.
En reacciones orgánicas, especialmente aquellas que involucran compuestos muy reactivos (como nucleófilos o electrófilos), se prefieren disolventes químicamente inertes. El agua, por ejemplo, puede resultar demasiado reactiva, ya que puede participar en reacciones ácido-base o actuar como nucleófilo, lo que puede dar lugar a productos secundarios no deseados. En cambio, disolventes apolares o polares apróticos, al carecer de esta reactividad, favorecen condiciones de reacción más limpias y controladas.
Ejemplos de disolventes apolares
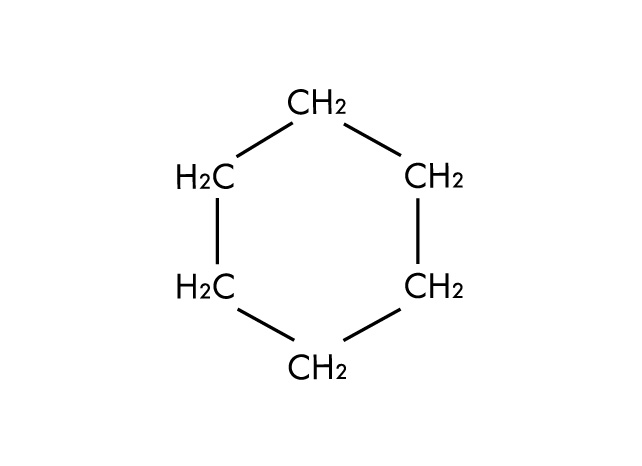
Estructura molecular del ciclohexano, un disolvente apolar aprótico.
Aplicaciones comunes en química y biología
Los disolventes desempeñan múltiples funciones clave en laboratorio. Algunos de los usos más destacados incluyen:
Los disolventes actúan como medio de reacción donde tienen lugar muchas reacciones químicas. Su elección influye en la solubilidad de los reactivos, la velocidad de reacción y el tipo de mecanismo (por ejemplo, SN1 o SN2).
Sustancias como la acetona o el etanol se usan comúnmente para limpiar material de vidrio o superficies, debido a su capacidad para disolver grasas, polímeros o contaminantes.
En biología, los disolventes se emplean para extraer metabolitos de tejidos. Ejemplos clásicos incluyen:
En técnicas como la cromatografía líquida de alta resolución (HPLC) o la cromatografía en capa fina (TLC), los disolventes actúan como fases móviles (eluyentes).

Conclusiones
Los disolventes son herramientas químicas esenciales para cualquier laboratorio. Desde la disolución de sustancias inorgánicas en agua hasta la extracción de lípidos o alcaloides, los disolventes tienen una multitud de aplicaciones y su papel es determinante en la química, la biología y muchas otras disciplinas científicas.
Los disolventes que ofrecemos en Labbox:
Atención
Los productos químicos Labkem son para uso exclusivo de laboratorio y su manipulación debe ser única y exclusivamente por profesionales en la materia. Los productos químicos son peligrosos, respete las instrucciones contenidas en la ficha de seguridad. Las fichas de seguridad son descargables gratuitamente en nuestra página web www.labbox.es
Para guardar su carrito en su área personal o solicitar un presupuesto, inicie sesión o regístrese.
De este modo, podrá acceder a sus carritos guardados siempre que lo necesite.
No obstante, si lo prefiere, puede copiar o reenviar el enlace de este carrito a su correo electrónico para recuperar el contenido más tarde.
La opción de solicitar un presupuesto solo está disponible para usuarios registrados.
Por favor, inicie sesión o cree una cuenta para poder utilizar esta funcionalidad.